Ozono
| Ozono | |
|---|---|
[[Archivo: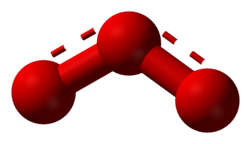    |220px]] |220px]] | |
| Nombre (IUPAC) sistemático | |
| Trioxígeno | |
| General | |
| Fórmula estructural | ver imagen |
| Fórmula molecular | O3 |
| Identificadores | |
| Número CAS | 10028-15-61 |
| Propiedades físicas | |
| Estado de agregación | Gas |
| Apariencia | Azul pálido |
| Densidad | 2.140 kg/m3; 0,00214g/cm3 |
| Masa molar | 47,998 g/mol |
| Punto de fusión | 80,7 K (-192 °C) |
| Punto de ebullición | 161 K (-112 °C) |
| Viscosidad | N/A |
| Índice de refracción | 1,2226 (liquid) |
| Propiedades químicas | |
| Solubilidad en agua | 0,105 g/100 mL (0 °C) |
| Termoquímica | |
| ΔfH0sólido | 142,3 kJ/mol |
| Riesgos | |
| Exposición mayor de 0,05 PPM | |
| Ingestión | N/R |
| Inhalación | >0,05 PPM por 8 horas |
| Piel | No reacciona |
| Ojos | Irritación a más de 0,05 PPM |
| Valores en el SI y en condiciones estándar (25 °C y 1 atm), salvo que se indique lo contrario. | |
El ozono (O3) es una sustancia cuya molécula está compuesta por tres átomos deoxígeno, formada al disociarse los 2 átomos que componen el gas de oxígeno. Cada átomo de oxígeno liberado se une a otra molécula de oxígeno (O2), formando moléculas de Ozono (O3).
A temperatura y presión ambientales el ozono es un gas de olor acre y generalmente incoloro, pero en grandes concentraciones puede volverse ligeramente azulado. Si se respira en grandes cantidades, puede provocar una irritación en los ojos y/o garganta, la cual suele pasar después de respirar aire fresco por algunos minutos.
Índice
[ocultar]Descubrimiento
El ozono es el primer alótropo de un elemento químico que fue identificado por la ciencia. En la actualidad no se conoce quién fue su descubridor original, pero varios estudios apuntan a los químicos Charles Fabry y Henri Buisson.
En 1840, Christian Friedrich Schönbein propuso que fuera un compuesto químicodistinto, nombrándolo con el verbo griego ozein (ὄζειν, "tener olor"), a causa del olor peculiar que se percibe durante las tormentas eléctricas. En 1865, Jacques-Louis Soret determinó la fórmula del ozono (O3)2 lo que fue confirmado por Schönbein en 1867. El ozono se descompone rápidamente en presencia de oxígeno a temperaturas mayores de 100 °C y en presencia de catalizadores como el dióxido de manganeso (MnO2) a temperatura ambiente. En condiciones normales, puede demorar varias horas en reconvertirse nuevamente en oxígeno.
Aplicaciones
El ozono se puede producir artificialmente mediante un generador de ozono.
El ozono tiene uso industrial como precursor en la síntesis de algunos compuestos orgánicos, pero principalmente, como desinfectante depurador y purificador de aguas minerales. Su principal propiedad es que es un fuerte oxidante. También es conocido por el importante papel que desempeña en la atmósfera. A este nivel es necesario distinguir entre el ozono presente en la estratosfera y el de la troposfera. En ambos casos su formación y destrucción son fenómenos fotoquímicos.
Cuando el oxígeno del aire es sujeto a un pulso de alta energía, como un rayo, el doble enlace O=O del oxígeno se rompe entregando dos átomos de oxígeno los cuales luego se recombinan con otras moléculas de oxígeno. Estas moléculas recombinadas contienen tres átomos de oxígeno en vez de dos, lo que origina ozono.
Ozono Atmosférico
El ozono atmosférico se encuentra en estado puro en diferentes concentraciones entre los 10 y los 40 km sobre el nivel del mar, siendo su concentración más alta alrededor de los 25 km (Ozonosfera), es decir en la estratosfera.
Actúa en la atmósfera como depurador del aire y sobre todo como filtro de los rayos ultravioletas procedentes del Sol. Sin ese filtro la existencia de vida en la Tierra sería completamente imposible, de ahí la gran importancia de la llamada “Capa de Ozono”. El ozono en su forma natural es un gas de color azul y de un olor picante muy característico. Se licúa a -111,9 °C y se solidifica a -193 °C.
El ozono en altas concentraciones y por períodos prolongados tiene efectos perjudiciales para la salud. Más allá de especulaciones (muchas de ellas de carácter publicitario) acerca de efectos beneficiosos a bajas concentraciones, la Organización Mundial de la Salud plantea que no hay ninguna evidencia de un umbral por debajo del cual no exista perjuicio. 3
Ozono Estratosférico
El ozono se encuentra de forma natural en la estratosfera, formando la denominada capa de ozono. El ozono estratosférico se forma por acción de la radiación ultravioleta, que disocia las moléculas de oxígeno molecular (O2) en dos átomos, los cuales son altamente reactivos, pudiendo reaccionar estos con otra molécula de O2 formándose el ozono.
El ozono se destruye a su vez por acción de la propia radiación ultravioleta, ya que la radiación con longitud de onda menor de 290 nm hace que se desprenda un átomo de oxígeno de la molécula de ozono. Se forma así un equilibrio dinámico en el que se forma y destruye ozono, consumiéndose de esta forma la mayoría de la radiación de longitud de onda menor de 290 nm. Así, el ozono actúa como un filtro que no deja pasar dicha radiación perjudicial hasta la superficie de la Tierra.
El equilibrio del ozono en la estratosfera se ve afectado por la presencia de contaminantes, como pueden ser los compuestos clorofluorocarbonados (CFCs), que suben hasta la alta atmósfera donde catalizan la destrucción del ozono más rápidamente de lo que se regenera, produciendo así el agujero de la capa de ozono. El daño que causan cada uno de estos contaminantes es función de su potencial de agotamiento del ozono, esto fue descubierto por los científicos Mario Molina (México),Frank Sherwood Rowland (EE.UU) y el holandés Paul J. Crutzen obteniendo por ello el Premio Nobel de Química en 1995.
Para medir la concentración de ozono en la atmósfera se utilizan instrumentos en satélites tales como GOMOS en el satéliteEnvisat.
Ozono Troposférico
También denominado ozono ambiental. Se trata de un gas incoloro que se crea a través de reacciones fotoquímicas entre óxidos de nitrógeno (NOx) y compuestos orgánicos volátiles (COV) derivados de fuentes como la quema de combustible. Es el compuesto más destacado de los oxidantes fotoquímicos y forma parte del llamado esmog fotoquímico.
Puede encontrarse en la zona más baja de la atmósfera, ya que proviene de emisiones naturales de COV, NOx y CO, así como del ozono estratosférico descendente. Esto se convierte en un problema puesto que el ozono, en concentración suficiente, puede provocar daños en la salud humana (a partir de unos 150 microgramos por metro cúbico) o en la vegetación (a partir de 30 ppb (partes por billón americano)) y contribuye a generar un calentamiento en la superficie de la tierra. Estas características del ozono han propiciado que dentro de la Unión Europea aparezca una normativa relativa al ozono en el aire ambiente (Directiva 2002/3/CE), que establece el nuevo régimen jurídico comunitario sobre el ozono troposférico presente en la baja atmósfera.
Su formación empieza a partir de la emisión del dióxido de nitrógeno (NO2) e hidrocarburos (compuestos que reaccionan en la presencia de calor y luz solar para producir ozono).
El mecanismo mediante el cual se genera el ozono en la troposfera es completamente distinto, ya que a esta altura no llegan las radiaciones ultravioletas. El ozono, en este caso, se forma a partir de ciertos precursores (NOx - óxidos de nitrógeno; y VOCs - compuestos orgánicos volátiles, como el formaldehído), contaminantes provenientes de la actividad humana. Estos contaminantes se disocian formando radicales con radiación menos energética, y dichos radicales pueden formar ozono con el oxígeno molecular.
El conjunto del ozono, NOx y COV forma una neblina visible en zonas muy contaminadas denominada smog fotoquímico o smog de verano, ya que, en el hemisferio norte, ocurre generalmente entre los meses de agosto y septiembre.
Referencias
- ↑ Número CAS
- ↑ Jacques-Louis Soret (1865). «Recherches sur la densité de l'ozone». Comptes rendus de l'Académie des sciences 61: pp. 941.
- ↑ Report on a WHO Working Group (2003) (pdf). Health Aspects of Air Pollution with Particulate Matter, Ozone and Nitrogen Dioxide. Consultado el 7/5/2012.
Véase también
- Agujero de ozono
- Capa de ozono
- Día Internacional para la Preservación de la Capa de Ozono
- Purificador de aire
- Purificador de agua
- Ozonoterapia
Enlaces externos
 Wikcionario tiene definiciones para ozono.
Wikcionario tiene definiciones para ozono.- El ozono en ambientes de trabajo - Norma OSHA EEUU
- Ozono estratosférico
- La Atmósfera de la Tierra
- Documento informativo sobre el ozono de la Agència de Salut Pública de Barcelona
- Efectos del ozono sobre la salud, resumen realizado por GreenFacts de un informe de la OMS.
- Producción del ozono
- Producción de energía limpia, Bio-gas.
- Calidad del aire interior en edificios comerciales e institucionales - Norma OSHA EEUU


No hay comentarios:
Publicar un comentario